Il s’agit là d’un sujet que je trouve particulièrement intéressant. La corrosion est l’un de ces phénomènes qui réunit plusieurs domaines scientifiques dans une seule observation. Dans cet article, nous nous intéresserons aux différentes phases qui entraînent la corrosion d’un métal. Sans plus attendre, commençons notre progression par l’élément principal qui est le métal.
Les caractéristiques du métal
La particularité d’un métal est que ses liaisons internes sont des liaisons métalliques. La liaison métallique peut être définie par un cristal métallique idéal qui correspond à un ensemble de cation présents dans un gaz d’électrons. Nous savons que deux charges de signe identique se repoussent et inversement, deux charges de signe opposé s’attirent. Il en est de même dans notre représentation du cristal métallique. Les électrons (les charges négatives), retiennent les cations (les charges positives) de notre assemblage. D’autre part, une particularité non négligeable dans la liaison métallique, est qu’un électron n’appartient pas à un atome plutôt qu’à un autre. De cette caractéristique découle des impacts significatifs sur les propriétés des métaux mais également, sur leurs capacités à se corroder. Tâchons de comprendre pourquoi.
La corrosion aqueuse
Afin de bien comprendre chaque étape menant à la corrosion, on s’intéresse ici uniquement à la réaction d’un métal divalent avec l’eau. Un métal divalent est un ion métallique dont la charge électrique positive est ![]() .
.
Physisorption et chimisorption
Prenons le cas d’une plaque de métal sur laquelle se trouve une goutte de solution composée essentiellement d’eau. Nous savons que la composition de l’eau est ![]() . Ainsi, l’eau est composée de 2 atomes d’hydrogène chargés positivement
. Ainsi, l’eau est composée de 2 atomes d’hydrogène chargés positivement ![]() , et d’un atome d’oxygène chargé négativement
, et d’un atome d’oxygène chargé négativement ![]() . De la même manière, dans notre plaque de métal, les atomes métalliques sont des cations (donc, chargés positivement), plongés dans un nuage d’électrons chargés négativement.
. De la même manière, dans notre plaque de métal, les atomes métalliques sont des cations (donc, chargés positivement), plongés dans un nuage d’électrons chargés négativement.
À l’interface entre le métal et la solution, la surface du métal est chargée positivement. Ceci est notamment dû à la dissymétrie de l’ensemble des cations en surface. Ainsi, la charge positive de la surface du métal attire les atomes d’oxygène des molécules d’eau de la solution. Ce phénomène se dénomme la physisorption et est de nature essentiellement électrostatique. Ensuite se met en place entre le métal et la molécule d’eau une liaison chimique, c’est ce que l’on appelle la chimisorption. On obtient alors une molécule adsorbée qui est ![]() , où
, où ![]() correspond au métal.
correspond au métal.
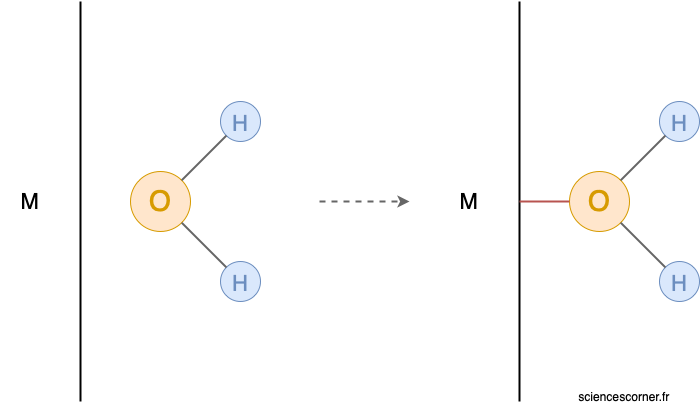
Nous voyons déjà dans un premier temps les prémices menant à la corrosion. Cependant, nous n’y sommes pas encore, quelques considérations sont encore à prendre en compte. Regardons ensemble ce qui se passe par la suite.
De la déprotonation à la corrosion
Nous avons vu précédemment que l’eau se lie au métal par chimisorption. Cette liaison entre le métal et l’eau amenuise les liaisons entre l’atome d’oxygène et ses atomes d’hydrogène. Les liaisons entre oxygène et hydrogène étant affaiblies, il en résulte alors la libération d’un atome d’hydrogène, ou encore une déprotonation. Cette réaction forme alors un nouveau complexe noté ci-dessous ![]() . À savoir que ce même complexe peut à nouveau subir une déprotonation, ce qui formerait un oxyde du métal
. À savoir que ce même complexe peut à nouveau subir une déprotonation, ce qui formerait un oxyde du métal ![]() .
.
![]()
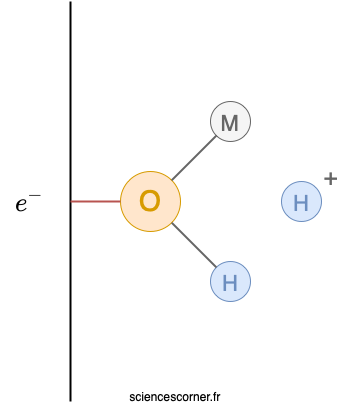
C’est alors à partir de ce complexe que se joue la corrosion ou non du métal. Il faut savoir que l’évolution de ce complexe dépend en particulier de l’environnement dans lequel est situé ce complexe. Considérons que cet environnement est propice à la corrosion. Alors, les deux réactions qui suivent amènent à la corrosion du métal.
Premièrement, le complexe ![]() s’oxyde selon le principe d’une réaction d’oxydoréduction.
s’oxyde selon le principe d’une réaction d’oxydoréduction.
![]()
Deuxièmement, l’oxyde formé se dissout en solution.
![]()
Nous voilà finalement arrivé au bout du processus amenant à la corrosion d’un métal en solution aqueuse. Toutefois, je trouve bon de m’attarder avec toi sur un point que je trouve particulièrement intéressant sur le phénomène corrosion.
Stabilité du métal dans un environnement vis-à-vis de la corrosion
La très grande majorité des métaux sont présents dans la nature sous forme d’oxyde. Il n’est donc pas commun pour un métal d’être dans un état exploitable comme nous pouvons les voir dans notre quotidien. Pour qu’un métal soit stable et qu’il ne se corrode pas, il est nécessaire que son utilisation soit adaptée à son environnement.
Tu verras qu’au travers des différentes réactions que nous avons vu précédemment, il y a toujours un échange d’électron ![]() ou un échange de proton
ou un échange de proton ![]() . Ces deux transferts traduisent la présence d’une différence de potentiel mais également d’une évolution du pH de la solution. Ainsi, il existe un diagramme où pour un métal, en fonction du potentiel et du pH de la solution, il est possible de savoir si le métal est dans un environnement stable vis-à-vis de la corrosion ou non. Ce diagramme se nomme le diagramme de Pourbaix.
. Ces deux transferts traduisent la présence d’une différence de potentiel mais également d’une évolution du pH de la solution. Ainsi, il existe un diagramme où pour un métal, en fonction du potentiel et du pH de la solution, il est possible de savoir si le métal est dans un environnement stable vis-à-vis de la corrosion ou non. Ce diagramme se nomme le diagramme de Pourbaix.
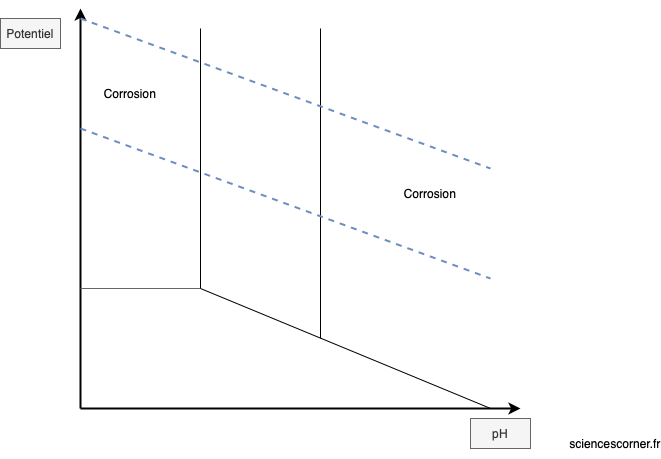
La corrosion en quelques mots
En fonction de l’environnement où il se trouve, un métal peut être sujet à la corrosion. La corrosion est le résultat d’une succession de réactions à la surface du métal entre les éléments en solution et le métal lui même. Ce phénomène se décline par une oxydation du métal par les espèces en solution, puis par une dissolution de cet oxyde. Ce phénomène qui tend à amener le métal dans un état plus stable peut être contrôlé dès lors que l’on maîtrise l’environnement d’utilisation de ce métal. Il existe notamment le diagramme de Pourbaix qui permet de connaitre en fonction du potentiel et du pH de la solution, les domaines de stabilité du métal.
Voilà une nouvelle connaissance sur le fonctionnement de notre monde à ajouter à ta liste ! J’espère que cet article te permet de bien cerner les différentes réactions qui s’appliquent lors de la corrosion et que maintenant, tu regarderas les oxydes de métaux sous un autre oeil. Je te dis à très bientôt pour de nouveaux sujets sur Sciences Corner.
Il y a encore beaucoup de choses à savoir sur la corrosion. Si tu souhaites entrer plus en profondeur sur cette thématique, cet ouvrage t’aidera dans ta quête d’apprentissage :
- Baroux, B (2014). La corrosion des métaux passivité et corrosion localisée. DUNOD
